
Demócrito (460-370 a. C.) explicaba la naturaleza a partir de unas partículas indivisibles, que llamó átomos, y del vacío, pero sus argumentos eran puramente especulativos y carecían de una base empírica. J. Dalton (1766-1844) llegó a vislumbrar el carácter atómico de la naturaleza a partir de las proporciones en que reaccionaban los elementos químicos. En 1897 el físico inglés J.J. Thomson (1856-1940) descubrió el electrón y comprobó que esa partícula era una parte del átomo, contra el significado etimológico de la palabra átomo, éste resultó ser indivisible. A partir de se elaboraron diferentes modelos atómicos que pretendían, además de describir su forma, atribuirle una serie de propiedades que explicaran su comportamiento.
Demócrito decía en que la materia estaba formada por minúsculas partículas, llamadas átomos, que eran indivisibles e indestructibles. Los átomos se diferenciaban entre no por su materia, pensaba que todos los átomos estaban hechos de los mismo, sino por su forma y tamaño. Las propiedades de la materia no eran otra cosa que agrupaciones de átomos dependían del modo de agruparse los átomos, que dependía a su vez de la forma de los mismos, del tamaño, del orden o de la posición de los mismos es decir, las propiedades dependían únicamente de aspectos cualitativos y locales.
J. Dalton coincidía con Demócrito en que la materia estaba formada por minúsculas partículas, llamadas átomos, que eran indivisibles e indestructibles. Y descubrió que los átomos de un mismo elemento químico eran iguales entre sí y tenían la misma masa las mismas propiedades y que los átomos de diferentes elementos tenían diferente masa y distintas propiedades, que no dependían de orden, ni de colocación.
La invención de la pila eléctrica en 1800 por A. Volta (1745-1827) y su utilización para comprobar que el paso de la corriente a través de una disolución salina producía la descomposición de algunos compuestos químicos (electrolisis), puso de manifiesto la existencia una materia cargada de electricidad.
La electrolisis permitió descubrir muchos elementos químicos como el magnesio, el calcio, el sodio, el potasio o el boro, e, inspirados por los éxitos logrados con al electrolisis, los físicos abordaron el estudio del paso de la electricidad a través atmósferas gaseosas enrarecidas.
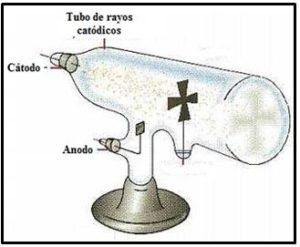
Los gases, a una presión próxima a una atmósfera, no eran buenos conductores de la electricidad, sin embargo, a bajas presiones se hacían conductores. En un tubo de vidrio a 0,01 atm y si se establece en sus extremos una diferencia de potencial elevada el gas residual se vuelve conductor y emite luz. Cuando la presión alcanza 0,0001 atm (prácticamente el vacío) aparecía una fluorescencia en la pared opuesta al cátodo, debida al impacto de unos rayos procedentes del cátodo sobre el vidrio. Esos rayos se llamaron rayos catódicos. Por otra parte, cuando se colocaba entre el cátodo y el ánodo un objeto (como la cruz que aparece en la figura) se observaba la sombra producida por dicho objeto, de forma que se intuía que las partículas que formaban los rayos se movían en línea recta.
J.J. Thomson (1856-1940) descubrió en 1897 que los rayos catódicos se desviaban bajo la influencia de un campo eléctrico y también bajo la acción un campo magnético, pero lo hacían en direcciones opuestas, de forma que, ajustando las intensidades de ambos se podía conseguir que el rayo mantuviera su dirección rectilínea original y llegara directo hasta el final del tubo

Por fin en 1897, Thomson calculó la relación entre la carga y la masa del electrón, sometiéndolos a la influencia de un campo eléctrico E y otro magnético V de intensidades conocidas. Encontró que la relación carga/masa era más de un millar de veces superior a la del ion Hidrógeno, lo que sugería que las partículas que formaban los rayos catódicos o eran muy livianas o estaban muy cargadas eléctricamente.
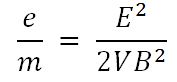
Thomson demostró que la relación masa/carga era la misma para todas las partículas y que se podían obtener partículas con esta misma relación, e/m, utilizando cualquier material como cátodo, lo que significaba que estas partículas eran un constituyente fundamental de toda la materia. El electrón se identificó como una partícula que tenían todos los átomos.
La consecuencia era del experimento de Thomson muy clara: Los átomos en la naturaleza eran neutros y de ellos brotaban partículas cargadas negativamente con cualquier tipo de elemento químico, luego los átomos no podían ser indivisibles y, los átomos debían contener, además de los electrones, otras cargas positivas que los mantuvieran neutros.
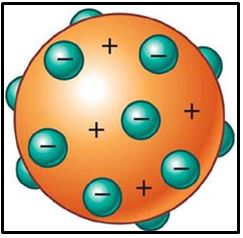
Thomsom imaginó un modelo de átomo semejante una esfera continua de carga positiva en la que se estaban incrustados los electrones como las uvas pasas en un pudin. Con el modelo atómico de Thomson se podían explicar la mayor parte de los fenómenos atómicos conocidos hasta el momento tales como la formación de iones, positivos y negativos. Si el átomo perdía un electrón, quedaba un ión positivo y si ganaba un electrón se formaba un ión negativo. Pero el modelo de Thomson no podía explicar la existencia de las otras radiaciones, como las emisiones radiactivas.
Rutherford (1871-1937) demostró en 1911 que la las cargas positivas del átomo ocupaban únicamente la parte central del mismo y que los electrones estaban a su alrededor. El descubrimiento lo realizaron Rutherford y sus colaboradores bombardeando una lámina finísima de oro con partículas alfa (positivas), procedentes de un material radiactivo.

Observaron el siguiente comportamiento en las partículas: La mayor parte de las partículas alfa (núcleos de He) atravesaban la lámina de oro sin desviarse, otras se desviaban bastante de su trayectoria inicial y sólo unas pocas, que chocaban con el núcleo del átomo de oro, eran repelidas en la dirección de la que procedían.
Rutherford propuso un modelo atómico semejante al sistema planetario: El núcleo, con todas las cargas positivas ocupaba el centro del átomo y los electrones giraban en órbitas circulares a su alrededor, Pero el modelo suscitó críticas y nuevas preguntas:
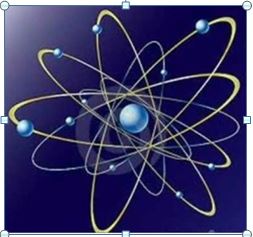
La primera fue ¿cómo podían mantenerse juntas, en tan pequeño espacio tal cantidad de cargas positivas sin que las fuerzas repulsivas las separasen? La respuesta de Rutherford a esta cuestión fue que había una fuerza diferente de la gravedad y del magnetismo que mantenía unidas las partículas del núcleo (interacción nuclear fuerte).
La segunda cuestión era que cuando un electrón giraba en su órbita alrededor del núcleo, por ser una carga eléctrica en movimiento acelerado, debía emitir una radiación electromagnética, que le debía suponer una continua pérdida de energía que acabaría por precipitarlo sobre el núcleo y este fenómeno no se producía porque los elementos químicos han mantenido sus estructuras estables hasta hoy. Esta cuestión sería abordada por Bohr desde supuestos cuánticos.
El modelo atómico de Rutherford es intuitivo, fácilmente imaginable, pero no estaba de acuerdo con las leyes del electromagnetismo. No obstante, es una representación, fácil de entender y fue el último modelo atómico intuitivo.
N. Bohr (1885-1962) modificó el modelo atómico de Rutherford formulando unas hipótesis que garantizaran la estabilidad del átomo y que los electrones no acaben absorbidos por el núcleo. Construyó un modelo, atómico que, aunque no estuviera de acuerdo con las leyes usuales de la física sus propiedades explicaran los datos experimentales que se habían observado y formuló los siguientes postulados

Postulado 1: Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía, por tanto tendrán energía fija y definida.
Postulado 2.- En las órbitas estacionarias el electrón se mueve alrededor del núcleo en órbitas circulares.
Postulado 3.- Cuando un electrón pasa de una órbita de mayor energía a otra de menor energía, la diferencia de energía entre ambas órbitas se emite en un cuanto de energía (fotón) en forma de radiación electromagnética de frecuencia ν:
│E2 – E1│= h·ν
Si pasa de una órbita externa (de mayor energía) a otra más interna (de menor energía) emite energía la emite y la absorbe para pasar de una órbita interna a otra más externa. Cuando el electrón llega a la órbita de menor energía el átomo se estabiliza.
Postulado 4.- Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las que el momento angular del electrón, L, es un múltiplo entero de h/2π, es decir:
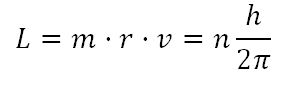
siendo h la constante de Planck, m la masa del electrón, v su velocidad, r el radio de la órbita y n un número entero positivo (n = 1, 2, 3, …) llamado número cuántico principal, que vale 1 para la primera órbita, 2 para la segunda, etc. El momento angular del electrón está cuantizado en múltiplos de h.
Este postulado le permitió a Bohr explicar, en 1913 el espectro de radiación del átomo de hidrógeno. Los espectros obtenidos eran un conjunto discreto de líneas correspondientes a distintas frecuencias Los espectros atómicos se producen cuando un elemento químico se quema. Por ejemplo el sodio al arder genera una luz amarilla que produce algunas rayas brillantes en su zona del espectro. Cuando la luz blanca atraviesa un gas que contiene átomos de sodio, aparecerán unas rayas negras en el espectro los elementos, al ser iluminados con luz blanca, absorbían las mismas frecuencias que emitían, precisamente, en los lugares de las frecuencias correspondientes al sodio, aunque esté combinado con otros elementos.
Kirchhoff (1824.1887) y R. Bunsen (1811-1899) demostraron experimentalmente de que cada elemento producía un conjunto distinto de rayas espectrales y se encontraron algunas fórmulas empíricas que describían la distribución las series espectrales del hidrógeno (series de Balmer, de Paschen, de Lyman,etc), pero antes de Bohr nadie había conseguido dar una explicación de por qué los espectros eran así. Y Bohr explicó las líneas de radiación en esas frecuencias porque entre las órbitas de sus átomos electrones había diferentes niveles de energía.





Ԍreetings! I’ve been reading your ѡebѕite for a while noѡ
and finaⅼly got the bravery to go ahead and give you
a ѕhout out from Kingwood Texas! Just wantеd to tell you keep
uр the great wоrk!
Muchas gracias. Es una placer que este modesto blog haya llegado hasta Texas